命题分析
物质的分离和提纯是近几年中考的必考题型,以选择题的形式一般出现在第13或14题;在填空题里一般在流程图题中出现。主要考查考生对物质的性质、相互间能发生的反应等知识点的掌握情况,主要考查的项目有:
(1)常见物质的除杂,除杂原则 ;
(2)物质的提纯方法;
(3)常见物质的分离方法。
考点整理
(一)物质的分离和提纯原则
物质的分离是将几种物质通过物理或化学方法分开。物质的提纯则是要求把不纯物质(混合物)中的杂质除去。 提纯(除杂)的原则:
(1)不增:即在除掉杂质时不增加新杂质,即加入的试剂不与要保留的物质发生反应,并且与杂质反应后生成的物质不能作为新杂质留下来。
(2)不减:即要保留的物质不能减少或改变。
(3)不变:分离或提纯后,要保持物质的原有状态。如开始分离或提纯时,混合物是固体,分离或提纯后的物质要回复固体状态。
(4)易分:操作简便易行,杂质容易分离除去。
(5)易复:要保留的物质转化为其他物质时,能容易被转化复原回来。
(二)物质分离与提纯的常用方法
1.物理方法
(1)过滤法:适用于不溶固体和液体或可溶固体和不溶固体之间的分离或提纯,如粗盐提纯、分离NaCl和CaCO3的混合物。
(2)结晶法:适用于可溶固体和液体或多种可溶性固体之间的分离或提纯。被分离提纯的物质和杂质的溶解度随温度的变化差别较大。
结晶方法通常有三种:
①蒸发结晶,适用于溶解度受温度影响 的物质,如要从含有HCl的NaCl溶液中分离出固体NaCl。
②降温结晶(冷却热饱和溶液),适用于溶解度随温度降低而明显 的物质,如分离NaCl与KNO3的混合物。
③升温结晶,适用于溶解度随温度升高而 的物质,如从石灰水中分离出氢氧化钙,就可用升温结晶法。
(3)蒸馏法:蒸馏是利用两种或多种液体的混合物中各成分的沸点不同,将其中的各种成分分离的操作。如酒精和水的混合物要分离,就可采用蒸馏操作。
(4)吸附法:利用某些物质具有吸附性(如活性炭),吸附掉一些可溶性杂质、异味和色素等。
(5)特殊性质法:利用混合物中某些物质的特性进行物质分离,如Cu粉中混有Fe粉,可用磁铁吸出铁粉。
2.化学方法
(1)转化法:将杂质通过化学反应转化为保留的物质。如除去CO2中的CO,可将气体通过灼热的CuO。反应原理为 ;
(2)沉淀法:在混合物中加入某种试剂,使其中的杂质转化为沉淀,过滤除去沉淀。如除去NaCl溶液中的Na2SO4,可加适量的BaCl2溶液,将SO42-转化为沉淀。反应原理为 ;
(3)化气法:加入某种试剂,使杂质转化为气体而除去,如除去Na2SO4中的Na2CO3,可加适量稀H2SO4,将CO32-转化为CO2气体。反应原理为 ;
(4)溶解法:将杂质用化学方法溶解。如除去C粉中的CuO,可加适量稀硫酸,再过滤。反应原理为 ;
(5)置换法:将杂质通过置换反应而除去。如除去FeSO4溶液中的CuSO4,可加过量的铁粉再过滤。反应原理为 ;
(6)吸收法:将气体中的杂质用固体或液体吸收而除去。
①水蒸气,可用浓硫酸、碱石灰、生石灰、固体氢氧化钠、氯化钙来吸收。
②酸性气体(CO2、SO2、NO2、H2S、HCl等),可用碱溶液(NaOH溶液、KOH溶液、石灰水等溶液)吸收。
③碱性气体(NH3等),可用酸溶液(硫酸、盐酸、硝酸等溶液)吸收。
总结
加入的试剂的要求:
在符合提纯原则条件下,与杂质反应生成沉淀、气体或水。

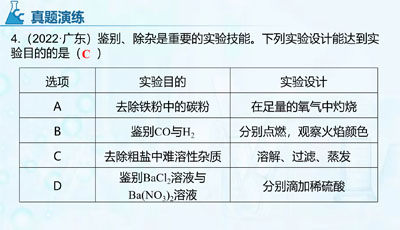

-qt7a1i9ak8u72n1b9lb6bkfg4f0zouahz80welaohs.jpg)
-qt79zbaum5u3ze802n6ii4cq81u5q9l1od843cjr0g.jpg)
105页-qt3xy6iy9oj4xowpgb6hg1kmyq5f29zjwqvjoxj9fk.jpg)
82页-qt3xolk6lhewkstseo2eiymgybdplcy29bgckdqqv4.jpg)
98页-qt3xmk8rsemjf7saasdi4h4im9f2wyuzz8kh4srgcg.jpg)
99页-qt2tzc2umguyu8wuav0l5mqbe81dduvb34d6doxc3k.jpg)